複数分子同時イメージング装置の開発とその応用研究
2010年10月29日

榎本 秀一(えのもと しゅういち):
岡山大学大学院医歯薬学総合研究科(薬)医薬品機能分析学分野 教授、(併任)独立行政法人理化学研究所神戸研究所・分子イメージング科学研究センター 複数分子イメージング研究チーム チームリーダー
略歴
1964年10月 横浜生まれ
1991年 3月 北海道大学大学院薬学研究科博士後期課程修了、薬学博士
1991年 4月 日本学術振興会PD特別研究員
1994年 4月~2000年3月 理化学研究所入所 核化学研究室と加速器基盤研究部 奨励研究員、基礎科学特別研究員、研究協力員などを歴任
1995年10月~2008年9月 早稲田大学理工学部化学科 非常勤講師(兼務)
2000年4月~2008年9月 理化学研究所基盤研究部 先任研究員、同分子イメージング研究プログラム 研究員(併任)、同仁科加速器研究センター 副チームリーダー、研究ユニットリーダー等を経て2008年10月から現職。
行政等の委員会委嘱経歴
1999年 4月 文部科学省原子力クロスオーバー基盤研究 マルチトレーサー研究交流委員会委員(~2003年3月)
1999年10月 文部科学省原子力クロスオーバー基盤研究 放射核種移行研究交流委員会委員(~2003年3月)
2005年 4月 環境科学技術研究所 元素集積植物調査研究評価委員会評価委員(~現在)
現在の研究テーマ
マルチトレーサー法、複数分子同時イメージング、プローブ創薬、メタロミクス研究(生体金属関連反応の科学)。
主な著書
“生命元素の事典”(分担執筆、オーム社)
受賞歴
2001年7月 日本微量元素学会研究学術賞
2007年11月 第44回ベルツ賞1等賞
2010年3月 日本薬学会学術振興賞
本村信治(独立行政法人理化学研究所神戸研究所 分子イメージング科学研究センター複数分子イメージング研究チーム)
1.はじめに
ヒトゲノムの解読以後、生命科学研究の主流は生体内の分子機能の解明に重心が置かれるようになった。近年は、さまざまな分子機能を生物が生きたまま可視化し、定量的な機能解析を可能にする分子イメージング技術の需要が高まっており、現在までに、光イメージング、PET(Positron Emission Tomography)、SPECT(Single Photon Emission Computed Tomography)、MRI(Magnetic Resonance Imaging)など様々な原理の技術が実用化されている。なかでもPETおよびSPECTは、放射性同位元素(RI,radioisotope)を標識した分子プローブを用いる核医学の撮像手法であり、感度や定量性が高く、投与量が微量で済み毒性が低いなどの利点があるため、臨床用分子イメージング装置として適しており、現在はガイドライン策定などの制度面での整備も行われているところである。
また、近年の研究成果は、生命現象が体内の様々な分子や各種元素の複合的な活動によって成立していることを明らかにしている。つまり、非侵襲的かつリアルタイムに、複数の分子ダイナミクスを同時に捉える「複数分子同時イメージング」が可能になれば、疾病に関与する複合的な要因も正確に識別し、その時点における最適な治療を選択可能な、より有用な診断情報を得ることが可能になると考えられる。言うまでも無く、その他の基礎医学、生物学など様々な研究領域においても、革新的なブレイクスルーがもたらされると期待される。しかしながら、同時に複数の分子挙動の画像化を実現しているのは、現状では光イメージング技術のみであり、撮像対象の大きさの制限やイメージング剤の毒性の問題があるため、この手法では臨床用分子イメージング装置の実現は困難である。
2.GREI による複数分子同時イメージング法
著者らは、複数分子同時イメージングを実現する新しい分子イメージング装置として、高純度ゲルマニウム(Ge)半導体検出器を用いた半導体コンプトンカメラ「GREI」(Gamma-Ray Emission Imaging)の開発を行ってきた[1]。コンプトンカメラはPETやSPECTと同じくγ線によって放射線源の空間分布を画像化する装置であるが、様々なエネルギーのγ線を識別して同時に画像化できる特徴がある。コンプトンカメラの概念自体はγ線天文学用の装置として1973年に考案され[2]、翌年には医学診断用装置としても提案されており[3]、その後もコンプトンカメラの医用画像診断法への応用を目指した機器開発は世界中で試みられているが、なかでもわが国の研究は先んじて進捗している。
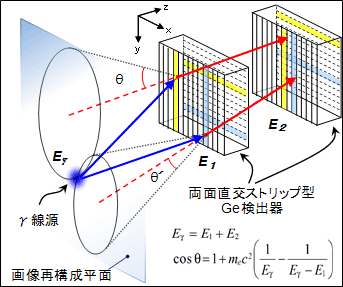
図1.GREIの撮像原理図
コンプトンカメラの撮像原理は、2台の位置感応型γ線検出器を並べることにより、γ線と物質の相互作用の一つであるコンプトン散乱事象を捉え、γ線の入射方向を特定することにある。図1に示したGREIにおける撮像原理図を例にとると、1段目の検出器に入射したγ線がコンプトン散乱され、その散乱γ線が2段目の検出器で全吸収された場合、γ線の散乱角θは次のコンプトン散乱の公式から求められる:
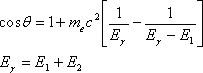
ここで、Eγは入射γ線のエネルギー、E1は1段目の検出器で測定されたエネルギー、E2は2段目の検出器で測定されたエネルギー、mec2は電子の静止質量エネルギーである。この方程式から1段目と2段目で測定されたγ線の相互作用点を結ぶ直線を軸とし、1段目の検出器における相互作用点を頂点とした、散乱角θの2倍の開角を持つ1つの円錐面が定まる。その円錐面はγ線源の位置を通るため、多数の測定から定められる円錐面の重ね合わせから、γ線源の位置の描出が可能となる。
この様に、コンプトンカメラ方式の大きな特徴は、機械的なコリメータを必要としないγ線撮像装置であるという事である。そのため、従来のSPECTに比べて格段に広いエネルギー範囲のγ線イメージングが可能であり、また、γ線の入射方向の制限がないため、1つの方向からの固定撮像であっても複数の方向へ投影した3次元分布の情報を得ることが理論上可能となる。

図2.GREIプロトタイプ、写真右側中央が本体部分
現在のGREIのプロトタイプ(図2)は、両面直交ストリップ電極式の平板型Ge半導体を2つ平行に並べて一つの装置に組み込んでおり、各検出器の電極面の寸法は39 mm×39 mm、前段の厚さは10 mm、後段は20 mmである。それぞれの検出器は陽極・陰極が直交する方向に3 mm幅のストリップ状に分割されている。高純度Ge半導体検出器の持つ高いエネルギー分解能と、この電極分割によるγ線の検出器中での相互作用点の位置検出によって、コンプトンカメラの原理によるγ線源分布のイメージングが可能となっている。さらに、複数の核種から放出されるγ線をエネルギーによって識別して別々に線源分布を特定することが可能であるため、異なる分子プローブ(生体内分子機能のイメージング剤)ごとに異なるγ線放出核種を標識し、それらを同時に投与して撮像することにより、複数分子同時イメージングが可能になる。
3.生きたマウスで複数分子同時イメージング実証
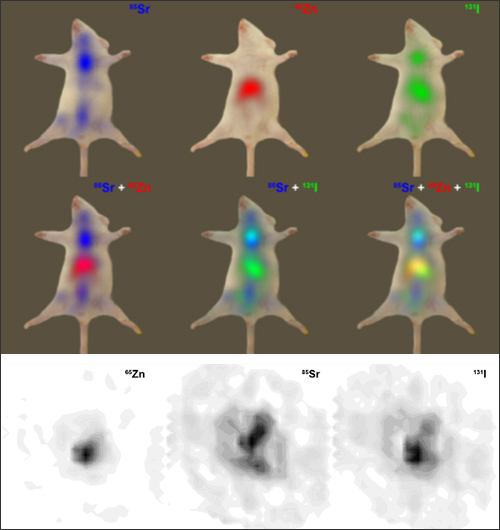
図3.実証実験の結果、マウス写真との重ね合わせ(上図)と3次元画像再構成像(下図)
著者らはGREIのプロトタイプを用いて生きたマウスの撮像実験を行い、世界で初めて複数分子同時イメージングの実証に成功した[4]。この実験では特に、生体内で異なる反応を示す3種類の放射性薬剤を同時に投与して撮像し、それぞれの薬剤の分布の違いを明確に識別可能であることが示された。図3は、正常マウスに65ZnCl2(1116 keV)、85SrCl2(514 keV)および副腎シンチグラム用放射性医薬品アドステロールⓇ-131I注射液(364.5 keV、富士フィルムRIファーマ株式会社)を投与し、麻酔下で12時間連続撮像した結果である。Znが肝臓に、Srが骨に集積している様子や、アドステロールの副腎集積および遊離Iの甲状腺集積を明確に区別して捉えている。さらにこの実験では、撮像データから時系列画像の再構成にも成功し、装置の改良によりリアルタイムに撮像中の線源分布の変化を捉えられることを実証した。
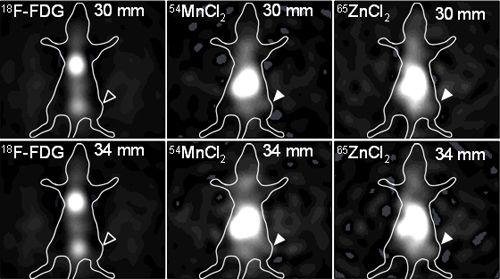
図4. 担がんマウスの18F-FDG、54Mn、65Zn3核種同時イメージング像
また、PET用放射性医薬品を用いたイメージング実験として、担がんマウスにPET用放射性医薬品の18F-fluorodeoxyglucose (FDG、511 keV)、54MnCl2(834 keV)、65ZnCl2を投与して12時間撮像した結果を図4に示す。BALB/c nu/nuマウスを用いてC6 細胞株を右大腿部に移植して担がんマウスを作成した。54MnCl2(0.9 MBq)、65ZnCl2(2.0 MBq)を投与後12時間絶食し、18F-FDG(3.5 MBq)を投与し、40分間飼育してから撮像開始した。腫瘍部を捉えるため検出器からの距離30 mm、34 mmの位置での2次元画像再構成を行った結果、腫瘍部への54Mn、65Znの集積が観察できたが、18F-FDGの腫瘍部への集積は見られない。Mn、Znはともに腫瘍への集積性が高いことが報告されている[5, 6]。18F-FDGはグルコーストランスポーターによって細胞内に取り込まれるため、糖代謝の高い腫瘍に集積性があるが、全ての腫瘍において高い集積を示すとは限らない。複数分子同時イメージングによって、多様な機序による集積性を利用し、より高感度な診断を実現できる可能性を示している。
このように、GREIでは高いエネルギー分解能によって複数のγ線を同時識別可能であるため、核種ごとの分布を画像化することができ、PET用プローブや一部のSPECT用プローブも撮像可能であることが実証された。
4.複数分子イメージング用プローブの開発
複数分子同時イメージングの有用性を明確に示すためには、複数分子の利用を念頭に置いた新しいコンセプトの分子プローブ開発を行う必要がある。このプローブ開発は装置開発と同時並行的に進める必要があるが、現在のGREIはまだ試作段階であり、この装置でプローブの機能評価を十分に行うのは困難である。そこで、十分技術開発が成されている既存の分子イメージング機器を用いてプローブ開発を行い、複数分子イメージング用プローブへ転換することが望ましい。
プロトタイプGREIによるイメージングに適した条件としては、長時間撮像に耐える長い生物学的半減期、より少ないイベント数で検出可能な局所集積性が挙げられる。そこで著者らは、比較的長い物理的半減期を持つポジトロン放出金属核種64Cuによって標識した生体高分子プローブと、動物用PET装置を用いたプローブ探索を進めている。標識には様々な金属核種標識に利用可能な1,4,7,10-tetraazacyclododecane-N,N’,N’’,N’’’-tetraacetic acid (DOTA)をキレーターとして採用しており、PETイメージングの後標識核種を他のγ線放出核種に変えることで複数分子イメージング用プローブ化が可能となる。ここで、最近のプローブ探索において行った抗体プローブによる担がんマウスイメージング結果を一つ紹介したい。上皮成長因子受容体(epidermal growth factor receptor: EGFR)高発現A431細胞株を用いて担がんマウスを作成し、抗EGFR抗体であるcetuximabを64Cuで標識した64Cu-DOTA-cetuximabを投与して実験を行った。また対象群として標識していない64CuCl2を投与して同様に撮像した。図5は23時間後から30分間のPETイメージング像と24時間後から12時間のGREIイメージング像の比較である。同一個体を用いて、PETとGREI両方で同様の腫瘍集積をイメージングすることに成功した。抗体医薬は悪性腫瘍の分子標的治療などに用いられるが、その適応の判断は難しく、抗原の発現を非侵襲的に検査可能な評価系が求められている。複数分子同時腫瘍イメージングは、非侵襲的に、複数の抗原について1度に評価可能であり、有効な診断情報となる可能性がある。
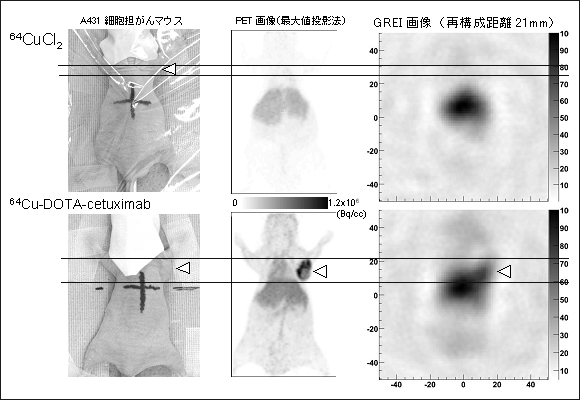
図5.同一個体によるPETおよびGREIによる担がんマウスイメージング
5.GREI 実用化のための技術開発
前述の通り、著者らは複数分子同時イメージングの実証に成功しているが、当時のGREIのプロトタイプを用いた典型的な撮像実験では、約4-5 mm の空間解像度の画像を得るために10時間程度の撮像時間を要しており、まだ実用的とは言い難い状況であった。そこで、さらなる画質の向上と撮像時間の短縮をめざし、GREIに実装される要素技術の高度化開発を行ってきた。特にGREIの主要な構成要素である電極分割型Ge半導体検出器は、信号処理法の高度化によって検出器固有の空間解像度や検出効率を格段に向上させることが可能である[7]。著者らは、開発した信号処理法を実装し[8]、感度および計数率特性を向上させたプロトタイプを構築し、2時間で約3mmの空間解像度の画像を取得することに成功している(図6)。現在もさらなる高度化開発を続けており、1時間以内の撮像で 1 mm の空間解像度の画像化を可能にすることを目標にしている。

図6.GREIの高度化開発による撮像性能の向上
また、臨床用GREI実現のための鍵となるのが、アレイ型コンプトンカメラである。現在のGREIのプロトタイプでは、十分な撮像性能が得られる視野が限られており、直径10cm、奥行き10cm程度である。そこで、撮像対象の周囲に複数の検出器を配置したアレイ型コンプトンカメラを構築することで、視野の拡大および感度の向上が実現し、また、より多方向への投影情報を得ることができるため、高精度の3次元画像化が可能になると考えられる。著者らは2台のGREIを組み合わせたアレイ型コンプトンカメラを構築し、原理の実証に成功した(図7)。この装置をさらにスケールアップし、全身撮像が可能な臨床用GREIを構築することが目標であり(図8)、計算機シミュレーションの結果、人体の深部でも2 mmの空間分解能の画像が取得可能であることが分かっている。

図7.アレイ型コンプトンカメラの実証

図8.臨床用アレイ型GREIのイメージ図
6.今後の展望
以上の様に、コンプトンカメラ方式を採用した複数分子同時イメージング装置「GREI」は、その要素技術の高度化によって撮像性能が着実に向上してきており、臨床用GREIの実現も急速に展開することが期待される。また、今後様々な疾患関連分子のプローブ開発を進めることにより、がんと炎症の区別、移植・再生医療における成功の判定など日常臨床における重要な診断基準のモニタリングに有用なツールとして、複数分子同時イメージングの果たす役割が示されて行くと考えられる。著者らの開発しているGREIが、近い将来、日本発の新しい診断装置として実用化されることを期待している。
主要参考文献:
- Motomura S, Enomoto S, Haba H, Igarashi K, Gono Y, Yano Y: Gamma-ray Compton imaging of multitracer in biological samples using strip germanium telescope. IEEE Transact Nucl Sci 54(3):710-717, 2007.
- Schönfelder V, Hirner A, Schneider K: A telescope for soft gamma ray astronomy. Nucl Instr Methods 107:385-394, 1973
- Todd RW, Nightingale JM, Everett DB: A proposed g camera. Nature 251:132-134, 1974
- Motomura S, Kanayama Y, Haba H, Watanabe Y, Enomoto S: Multiple molecular simultaneous imaging in a live mouse using semiconductor Compton camera. J Anal At Spectrom 23:1089-1092, 2008.
- Takeda A, Tamano H, Enomoto S, Oku N,: Zinc-65 imaging of rat brain tumors. Cancer Res 61:5065-5069, 2001
- Tamano H, Hirunuma R, Enomoto S, Takeda A: Uptake of radioactive elements in rat brain tumor. RIKEN Review 35:57-58, 2001
- Deleplanque MA, Lee IY, Vetter K, Schmid GJ, Stephens FS, Clark RM, Diamond RM, Fallon P, Macchiavelli AO: GRETA: Utilizing new concepts in g-ray detection. Nucl Instr Meth A 430:292-310, 1999.
- Fukuchi T, Motomura S, Kanayama Y, Haba H, Watanabe Y, and Enomoto S: Gamma-Ray Tracking for Ge Telescope Compton Camera Imaging, 2008 IEEE NSS Conference Record, N68-2, pp. 3499-3500, 2008.