腎臓発生・再生研究の現状と展望
2010年12月20日

西中村 隆一(にしなかむら りゅういち):
熊本大学 発生医学研究所 腎臓発生分野 教授
昭和62年 3月 東京大学医学部医学科卒業
平成 5年 8月 アメリカDNAX研究所客員研究員(平成7年12月まで)
平成 8年 3月 東京大学大学院医学系研究科第一臨床医学専攻博士課程修了、博士(医学)学位取得
平成 8年 4月 東京大学医科学研究所(幹細胞シグナル分子制御寄付研究部門)教員
平成12年 7月 同上客員助教授
平成16年 1月 熊本大学発生医学研究センター細胞識別分野教授
平成21年 4月 熊本大学発生医学研究所腎臓発生分野教授
はじめに
腎臓は生命維持に必須な臓器であるが、腎機能が失われても自然に再生することはない。その一つの原因は幹細胞が成体の腎臓にはないからだと考えられている。しかし胎児期には腎臓前駆細胞は確かに存在する。本稿では、特にネフロン前駆細胞の重要性を解説し、それをふまえて再生医療に向けての展開について考察する。
腎臓は中間中胚葉から発生し、前腎、中腎、後腎の3段階を経て形成される。前腎、中腎のほとんどは後に退行変性し、哺乳類成体において機能する腎臓は後腎である。この後腎の形成は尿管芽と後腎間葉との相互作用から始まる1)。後腎間葉はGdnfという液性因子を分泌して尿管芽を引き寄せる。後腎間葉に侵入した尿管芽はWnt9bを分泌し、それに反応した間葉は自らWnt4を分泌し、これが間葉自身に働いて、間葉は上皮性の管へと分化する(図1)。この管はその後S字型に変化し、その上部が近位尿細管、ヘンレのループ、遠位尿細管となり尿管芽と合流する。S字体の下部はボウマン嚢および糸球体上皮細胞 (ポドサイト)へと分化し、そこに毛細血管が入り込んで糸球体が形成される。一方、尿管芽は分岐を重ね、集合管と尿管になる。糸球体から尿細管に至る腎臓の最小機能単位をネフロンと呼び、最終的にヒトでは50万-100万個のネフロンが形成される。
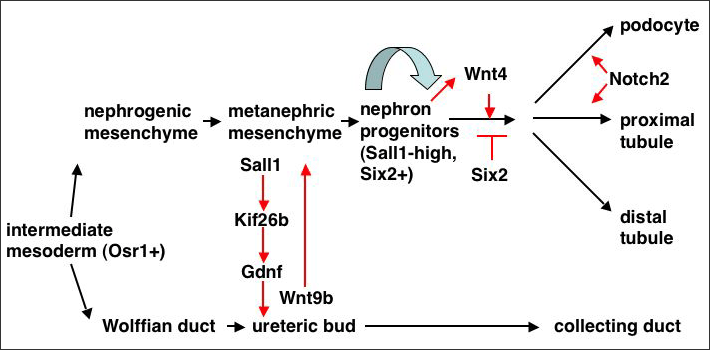
図1 腎臓発生の系統図
◆後腎は中間中胚葉(intermediate mesoderm)から発生した後腎間葉(metanephric mesenchyme)と尿管芽(ureteric bud)との相互作用により形成される。
◆後腎間葉中にSall1強陽性、Six2陽性のネフロン前駆細胞(nephron progenitor)が存在する。
間葉と尿管芽の相互作用
後腎間葉はGdnfを分泌して尿管芽を引き寄せるが、この発現を制御する転写因子はPax2, Six1, Eya1など多数知られている。我々が単離した核内因子Sall1の欠失マウスも尿管芽の引き寄せ不全を呈するが、Sall1がキネシンKif26bを制御し、これが間葉の接着を介して間接的にGdnfを維持している2)3)。間葉から分泌されたGdnfは、尿管芽先端に発現する受容体Retから転写因子Etv4/5を介して尿管芽の増殖、伸張、分岐を制御している4)。後腎間葉に侵入した尿管芽はWnt9bを分泌し、それに反応した間葉は自らWnt4を分泌し、これが間葉自身に働いて、間葉は上皮性の管へと分化する5)。
胎生期のネフロン前駆細胞
ポドサイトや尿細管は後腎間葉から発生するため、この中にネフロン前駆細胞が存在するのではないかと我々は仮定した。実際、後腎間葉を個々の細胞に解離し、分化誘導因子であるWnt4を発現するフィーダー上で培養すると、1個の間葉細胞からコロニーが形成され、糸球体、近位尿細管、遠位尿細管のマーカーを発現した6)。そこで、Sall1遺伝子座にGFP遺伝子を導入したノックインマウスを作成し、GFPによる蛍光を指標として間葉を選別すると、Sall1強陽性の分画からのみWnt4依存性のコロニーが形成された。さらに、これらのSall1高発現細胞を再凝集させ器官培養すると3次元構造を再構築し、糸球体や尿細管様の構造が認められた。よってSall1を高発現する間葉細胞は、ポドサイトや尿細管上皮への分化能をもった多能性のネフロン前駆細胞であるといえる。一方、ハーバード大学のMcMahonらは転写因子Six2を利用して、後腎間葉中にネフロン前駆細胞が存在することをin vivoで証明しており7)、我々の主張と一致している。またSix2ノックアウトマウスでは、後腎間葉でWnt4の発現領域が拡大し、間葉細胞の早熟な上皮化が起こり、前駆細胞が減少して腎臓の低形成を示す8)。よってSix2はWnt4シグナルを抑制することにより、ネフロン前駆細胞を未分化な状態に保つと考えられる(図1)。しかしネフロン前駆細胞の自己複製は一過性であり、生後すぐに前駆細胞は消失してしまう。これが成体の腎臓が再生しない原因の一つになっていると考えられるが、詳細な機構は未解明である。
ネフロン前駆細胞の分化制御
後腎間葉中のネフロン前駆細胞は、尿管芽からのWnt9bの刺激を受けてWnt4を分泌し、これがネフロン前駆細胞自身に働いて、上皮への転換が起きる。上皮には、近位—遠位軸が確立され、ポドサイト、近位尿細管、ヘンレのループ、遠位尿細管が形成されていく。この過程にはNotch2が必須であり、これを欠失するとポドサイト及び近位尿細管が形成されない9)。そこで我々は逆方向の実験、つまりSix2陽性のネフロン前駆細胞でNotch2を活性化できるマウスの作成を行った。Notch2が近位—遠位軸を決定するのであれば、ポドサイトや近位尿細管などの近位ネフロンが過剰に形成されるはずである。しかし実際にはそれは起こらず、むしろ顕著な腎臓低形成が観察された10)。ネフロン前駆細胞がSix2の低下に伴い枯渇し、Wnt4が上昇して早熟な上皮化が起こるというSix2欠失マウスと同じ現象が生じるためであった。よってNotch2は、近位—遠位軸の決定ではなく、決定後の維持に関わることが示唆された。腎臓の再生を視野に入れた場合、Notch2を活性化するだけでは前駆細胞を近位ネフロンに誘導するのは困難であるということでもあり、近位—遠位軸決定機構の解明が必須である。
腎臓の起源と誘導の試み
腎臓発生は間葉と尿管芽の相互作用からはじまり、これら2つが腎臓の管腔構造(糸球体や尿細管、集合管)を形成するが、血管内皮は間葉細胞の間に別系統の細胞として存在する。また間葉の外側にはFoxd1陽性の間質細胞が存在し、ここから管腔構造や血管の隙間を埋める間質が派生する11)。糸球体のメサンギウム細胞も間質に由来する。よって腎臓には間葉、尿管芽、血管、間質という少なくとも4つの細胞集団が存在することになり、間質と尿管芽の相互作用も報告されている。しかし発生を遡ると、これらはOsr1陽性の中間中胚葉から派生することが明らかになっている12)。
よって、ES細胞/iPS細胞からネフロン前駆細胞を誘導するには、まず中間中胚葉の誘導を目指すことになる。アフリカツメガエルでは、胞胚期の予定外胚葉領域(アニマルキャップ)をアクチビンとレチノイン酸で処理すると、前腎管が誘導される。前述のSall1もこの系を利用して単離したものである。カエルでの結果にヒントを得て、マウスES細胞からアクチビン、レチノイン酸およびBmp7存在下で胚様体を形成させ, 脊索と共培養すると, 中間中胚葉関連のマーカーを発現し、尿細管構造が確認されるとの報告もある13)。しかし、まだ胚様体全体の中に腎臓細胞が混在して誘導される可能性を示唆した段階であり、この中から前駆細胞だけを取り出すことが必要である。ここで大切なのは、前駆細胞が1個であっても検出できる機能的検定系の存在である。前述の後腎を用いたコロニーアッセイが中間中胚葉にも適用できるかが鍵になるだろう。
腎臓の再構築に向けての問題点
ネフロン前駆細胞や尿管芽細胞が誘導できたとして、そこから3次元構造をもった腎臓へと再構築するには何が必要だろうか?上述のように、Sall1を高発現するネフロン前駆細胞を再凝集させて培養すると、3次元構造が再構築されるが、腎臓本来の構造には及びもつかない。これは尿管芽との相互作用が欠如するためであると考えられ、この過程に働く分子機構の解明が急務である。尿管芽の分岐を模した生体吸収性素材の足場のまわりに間葉と上皮を発生させていくというティッシュエンジニアリング的手法も考慮する必要があるだろう。
また血液を濾過して尿を生成するという腎臓の機能を考えたとき、血管と腎管との接続は極めて重要である。ネフロン前駆細胞から由来する糸球体足細胞(ポドサイト)はVEGFを分泌し、これが糸球体血管内皮を引き寄せることがノックアウトマウスの結果から明らかになっている14)。またES/iPS細胞から血管への誘導法は確立されている15)。よってポドサイトが誘導できれば血管を引き寄せて糸球体を作ることは理論的に可能であろう。腎動脈が腎門部を通って皮質部で糸球体に注ぎ、その後皮質/髄質で対交流系を形成するようなin vivoの血管走行を模倣するのは現在の知識では困難である。しかし臨床的にはわずかな糸球体濾過量を確保するだけでも透析から離脱できるはずである。
ノックアウト動物のニッチとしての可能性
以上のような正攻法のアプローチには発生学的知識の進展が必須であるが、それを待たずに、動物の胎仔を使ってin vivoで腎臓を作ろうとする試みもみられる。横尾らはGdnfを発現するヒト間葉系幹細胞をラットの発生期腎臓領域に打ち込み、全胚培養ついで器官培養することによって、ヒトとラットの細胞が混じり合った腎臓を作り出している16)。それを体網に移植することによって少量の尿が形成されたとしている。今後ホストの細胞をどう除去するかが課題である。
中内らは、Sall1欠失胚盤胞にマウスES細胞を注入することによって、ドナー由来の後腎間葉を作製している(私信)。Sall1が欠失すると間葉には寄与しないので、すべてドナー由来となるわけである。しかし尿管芽や血管はホスト由来であり、今後これらすべてをドナー由来にしなければならない。また臨床応用を目指すにはヒトiPS由来の腎臓をブタ内部に作成する必要があり、種を超えたキメラ作成が可能にならなければならない。最近中内らはPdx1欠失マウス胚盤胞にラットiPS細胞を注入することによって、マウス体内でラット由来の膵臓を作製することに成功しており、大きな前進であろう17)。ヒト由来の細胞が全身臓器に大きく寄与した場合に倫理的取り扱いをどうするかといった課題も克服しなければならないが、ノックアウト動物を一種のニッチとして利用するという発想は興味深く、発展を期待したい。
おわりに
この10数年で腎臓発生のメカニズムもかなり解明されてきた。今後も腎臓の部位特異的ノックアウトマウスの作製などから新たな分子機構の解明が期待される。さらに、アメリカ主導のGUDMAP プロジェクトでは、発生期の腎臓で網羅的遺伝子解析を行い、それをもとに腎臓の各領域を蛍光ラベルしたマウスを作製し、そこから詳細な遺伝子発現解析を行っている18)。これらの知見が集積すれば、当然腎臓を再生するヒントになると考えられる。別法としては、成体の腎臓に存在する細胞を別の細胞へとリプログラミングすることが考えられる。実際、膵臓、神経、心筋で報告が相次いであおり、腎臓で実現する日も近いと期待される。
主要参考文献:
- Nishinakamura R, et al: Murine homolog of SALL1 is essential for ureteric bud invasion in kidney development.Development 128(16): 3105-3115, 2001.
- Uchiyama Y, et al: Kif26b, a kinesin family gene, regulates adhesion of the embryonic kidney mesenchyme. Proc Natl Acad Sci U S A. 107(20): 9240-9245, 2010.
- Lu BC, et al: Etv4 and Etv5 are required downstream of GDNF and Ret for kidney branching morphogenesis. Nat Genet 41(12): 1295-302, 2009.
- Carroll TJ, et al: Wnt9b plays a central role in the regulation of mesenchymal to epithelial transitions underlying organogenesis of the mammalian urogenital system. Dev Cell 9(2):283-292, 2005.
- Osafune K, et al: Identification of multipotent progenitors in the embryonic mouse kidney by a novel colony-forming assay.Development 133:151-161, 2006.
- Kobayashi A, et al: Six2 defines and regulates a multipotent self-renewing nephron progenitor population throughout mammalian kidney development.Cell Stem Cell 3: 169-181, 2008.
- Self M,et al: Six2 is required for suppression of nephrogenesis and progenitor renewal in the developing kidney.EMBO J 25: 5214-5228, 2006.
- Cheng HT, et al: Notch2, but not Notch1, is required for proximal fate acquisition in the mammalian nephron. Development 134: 801-811, 2007.
- Fujimura S, et al: Notch2 activation in the embryonic kidney leads to depletion of nephron progenitors. J Am Soc Nephrol 21(5):803-810, 2010.
- Kobayashi et al: Fate tracing reveals the pericyte and not epithelial origin of myofibroblasts in kidney fibrosis. Am J Pathol 176(1):85-97, 2010.
- Mugford JW, et al: Osr1 expression demarcates a multi-potent population of intermediate mesoderm that undergoes progressive restriction to an Osr1-dependent nephron progenitor compartment within the mammalian kidney. Dev Biol 324(1):88-98, 2008.
- Kim D and Dressler GR: Nephrogenic factors promote differentiation of mouse embryonic stem cells into renal epithelia.J Am Soc Nephrol 16: 3527-3534, 2005.
- Eremina V, et al: Glomerular-specific alterations of VEGF-A expression lead to distinct congenital and acquired renal diseases. J Clin Invest 111:707-716, 2003.
- Yamashita J, et al: Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature 408: 92-96, 2000.
- Yokoo T, et al: Human mesenchymal stem cells in rodent whole-embryo culture are reprogrammed to contribute to kidney tissues. Proc Natl Acad Sci U S A 102:3296-3300, 2005.
- Kobayashi T, et al: Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell 142(5):787-99, 2010.
- Brunskill EW, et al: Atlas of gene expression in the developing kidney at microanatomic resolution. Dev Cell 15:781-791, 2008.